人兽嵌合体为何难成功?华人团队Cell论文:抑制这个基因,有望在动物体内长出人类器官
来源:生物世界 2025-12-04 14:02
这一发现揭示了物种间屏障和细胞竞争的新机制,证明了靶向抑制宿主免疫通路是提高动物体内的人类细胞嵌合率的有效策略,为再生医学提供了更具安全性的“宿主改造”新范式。
利用人类多能干细胞(hPSC)创建跨物种嵌合体,为模拟人类发育和生成供体器官提供了前景广阔的策略,然而,人类细胞在其他物种中的整合效率低下,这也成为创建跨物种嵌合体面临的主要障碍。
目前改善人源细胞嵌合率的努力,多集中于对供体 hPSC 进行基因改造,而对宿主进行调控的研究仍然不足。
2025 年 11 月 24 日,德克萨斯大学西南医学中心吴军团队与基因组多维解析技术全国重点实验室/华大生命科学研究院顾颖团队合作(胡莹莹、孙海汐为论文共同第一作者),在国际顶尖学术期刊 Cell 上发表了题为:RNA innate immunity constitutes a barrier for interspecies chimerism 的研究论文。
该研究首次发现,在人类和小鼠的多能干细胞共培养中,通过“隧道纳米管”(Tunneling Nanotube,TNT)结构进行的跨物种 RNA 交换,可激活小鼠细胞的 RNA 先天免疫通路,进而通过“细胞竞争”清除人类细胞。
该研究进一步证实,敲除通路关键蛋白 MAVS 能够削弱小鼠细胞竞争力,在不修饰人类细胞的情况下,显著提升人类多能干细胞在小鼠胚胎中的存活率和嵌合率。这一发现揭示了物种间屏障和细胞竞争的新机制,证明了靶向抑制宿主免疫通路是提高动物体内的人类细胞嵌合率的有效策略,为再生医学提供了更具安全性的“宿主改造”新范式。

该研究的核心发现:
与人类多能干细胞共培养会触发小鼠多能干细胞的 RNA 先天免疫反应;
Mavs 基因的敲除削弱了小鼠多能干细胞的竞争力,提高了人类多能干细胞的存活率;
Mavs 缺陷型小鼠胚胎可提高人类多能干细胞在其体内的存活率和嵌合率;
物种间多能干细胞共培养,可实现直接的、接触依赖的水平 RNA 转移。
在科幻作品中,我们经常看到半人半兽的嵌合体生物。如今,科学家正在实验室中将这一想象变为现实——通过将人类干细胞注入动物胚胎,培育出含有人类细胞的跨物种嵌合体。这一技术有望在未来解决器官移植短缺的难题。
然而,该领域长期面临一个主要障碍:人类干细胞在动物胚胎中存活率极低。大多数研究试图通过对人类干细胞进行基因改造来解决这一问题,但成效有限。
意外发现:共培养触发小鼠细胞“警报”
在这项新研究中,研究团队建立了一个跨物种干细胞共培养系统,将人类多能干细胞(hPSC)与小鼠上皮干细胞一起培养。结果发现,人类细胞很快被小鼠细胞“淘汰”——这一现象被称为“细胞竞争”。
通过基因测序,研团队发现,共培养的小鼠细胞中有 422 个基因表达异常活跃,其中最突出的是 RLR 通路相关基因。RLR 通路是细胞抵御 RNA 病毒入侵的重要免疫机制,当检测到外来 RNA 时,会启动抗病毒反应。
也就是说,小鼠细胞把来自人类细胞的 RNA 当成了病毒 RNA,启动了免疫防御机制,进而清除了人类细胞。
机制揭秘:细胞间的水平 RNA 转移
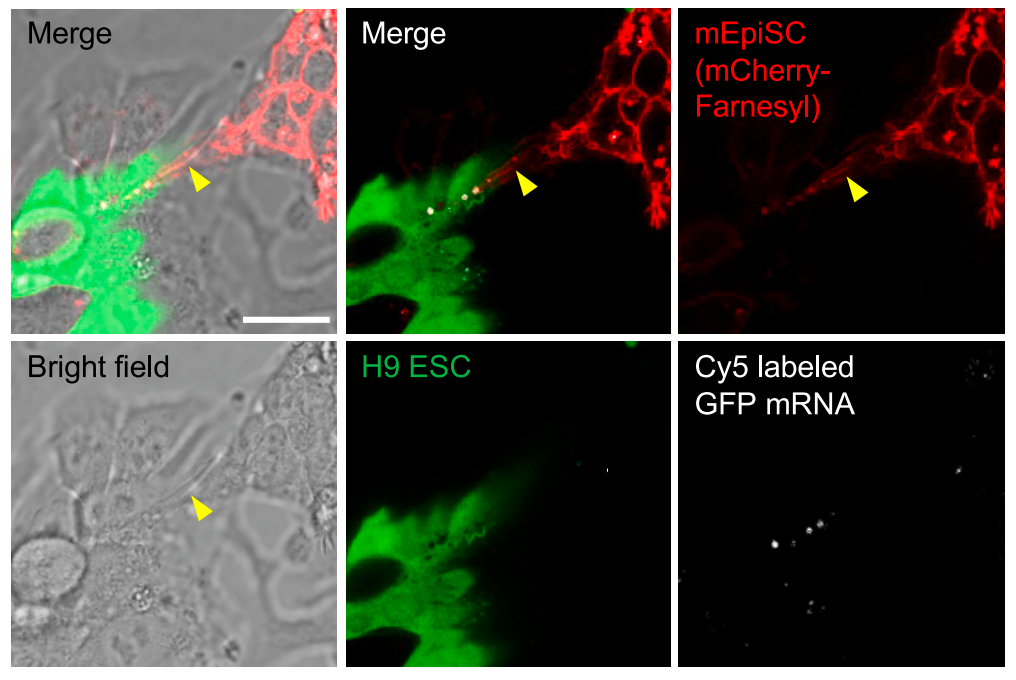
那么,小鼠细胞是如何检测到人类 RNA 的呢?研究团队进一步探索发现,小鼠细胞通过“隧道纳米管”(Tunneling Nanotube,TNT)直接从人类细胞中“窃取” RNA。
RNA 测序数据显示,共培养的小鼠细胞中含有少量来自人类细胞的 RNA,而在不直接接触的共培养体系中,这种现象几乎不存在。通过高分辨率显微镜,研究团队直接观察到了 RNA 通过“隧道纳米管”从人类细胞转移到小鼠细胞的过程。
这种细胞间的 RNA 转移是非选择性的,就像在两个细胞之间进行的随机信息交换。
关键突破:敲除 MAVS 可大幅提升人类细胞存活率
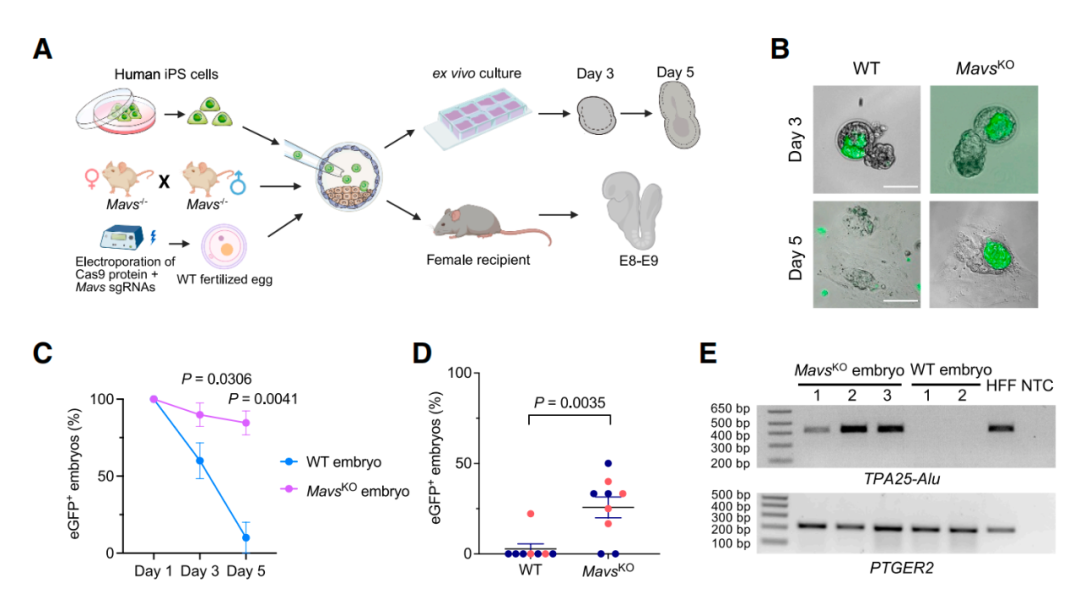
MAVS 是 RLR 信号通路中的关键蛋白。研究团队推测,如果 RLR 通路确实是人类细胞被清除的原因,那么敲除 Mavs 基因应当能改善人类细胞的存活情况。
进一步实验结果证实了这一猜想:与正常小鼠胚胎相比,Mavs 基因敲除的小鼠胚胎中的人类干细胞的存活率提高了近 4 倍。
更重要的是,这些人类干细胞成功整合到了小鼠胚胎的三个胚层(外胚层、中胚层和内胚层)中,成为真正的人-小鼠胚胎嵌合体。此外,通过抑制“隧道纳米管”形成的药物(L-778123)处理,也观察到了类似效果,进一步验证了该机制的可靠性。
应用前景:器官再生领域的曙光
这项研究不仅揭示了跨物种嵌合的新机制,还提出了一种创新策略:通过改造宿主胚胎而非人类供体细胞来提高嵌合效率。
传统方法需要对人类干细胞进行基因改造,这可能会带来安全风险。而该研究带来了全新方法——对动物胚胎进行改造,为未来的再生医学应用提供了更安全的路径。这一定向宿主改造策略与解决其他物种屏障的方法相结合,有望实现在动物体内(例如猪)培育人类器官的最终目标。
这项突破性发现不仅推动了基础科学的发展,也为解决器官移植短缺这一全球性难题带来了新希望。未来,或许能够通过动物体内定制用于移植的器官,挽救更多人类生命。
论文链接:
https://www.cell.com/cell/abstract/S0092-8674(25)01244-9
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


